在1型糖尿病患者中,身体的免疫系统会攻击并破坏产生胰岛素的β细胞,这些细胞是控制血糖水平的,是胰腺中称为胰岛的一组细胞的一部分。在Cell Reports Medicine上发表的一项研究中,由马萨诸塞州总医院 (MGH) 的研究人员领导的团队最近开发了一种移植胰岛的有效方法,并证明该方法可以有效逆转1型糖尿病非人类灵长类动物。
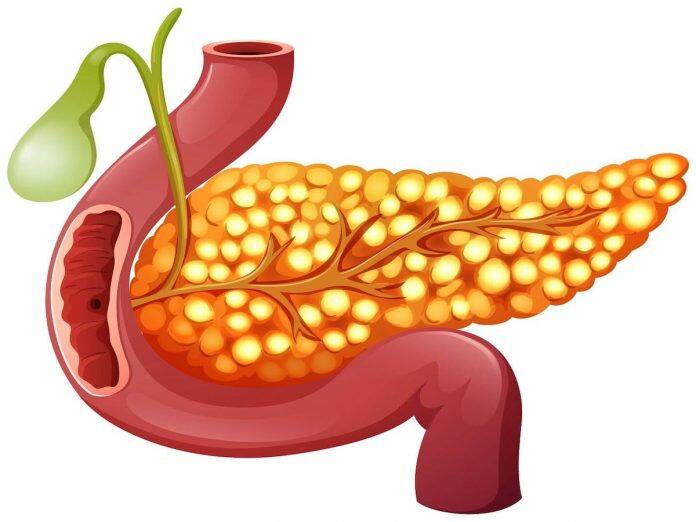
胰岛移植是一种很有前途的1型糖尿病治疗方法;然而,目前将胰岛移植到肝脏的方法效率低下,并且由于免疫攻击可能导致多达一半的移植β细胞丢失。此外,肝脏只能容纳有限体积的移植组织。科学家们想知道换个部位是否可以带来更好的结果。另一个最佳的部位是大网膜,这是一种从胃开始并覆盖在肠道上的脂肪组织。
为了优化将大网膜作为新的移植部位,研究人员使用局部重组凝血酶(止血)、一种酶和接受者自身的血浆来设计一种可生物降解的基质,通过该基质将供体胰岛固定在大网膜上。当这种策略与免疫抑制疗法一起使用以保护胰岛免受免疫攻击时,该方法使三只患有1型糖尿病的非人灵长类动物的血糖水平正常并恢复了葡萄糖反应性胰岛素分泌,只要对动物进行测试即可。
麻省总医院移植外科研究员、医学博士、理学硕士 Hong Ping Deng 说:实现完全的血糖控制归功于生物工程方法,它促进了移植胰岛的血运重建和神经再支配过程。
这项临床前研究可以为糖尿病β细胞替代新策略的开发提供信息,并可能改变目前临床胰岛移植的范式。研究人员正在计划进行一项临床试验来测试这种方法。
马萨诸塞州总医院人类胰岛/细胞处理特殊服务cGMP设施的主任指出,除了移植来自捐赠者的胰岛外,研究人员还在研究移植干细胞来源的胰岛的潜在广泛应用,这治愈了一个人类历史上首位1型糖尿病患者,并且可以提供源源不断的可移植组织。然而研究人员却对这种方法存在担忧,因为包括肿瘤发展的可能性。与肝脏不同,大网膜很容易用于监测,并且如果发生并发症,其非重要部位状态可以允许去除移植组织,无论是干细胞衍生的胰岛还是来自捐赠者的胰岛。此外,经过改造的网膜部位可以容纳许多其他类型的基因工程细胞。
合著者 James F. Markmann 医学博士、麻省总医院移植外科主任兼移植中心临床手术主任强调,非人类灵长类动物研究是一种高度转化的临床前动物模型。这种策略的应用,特别是在基于干细胞的治疗中,有可能彻底改变治疗1型糖尿病患者的模式。
其他合著者包括 Alexander Zhang、Dillon Ren Rong Pang、Yinsheng Xi、Zhihong Yang、Rudy Matheson、Guoping Li、Hao Luo、Kang M. Lee、Qiang Fu、Zhongliang Zou、Tao Chen、Zhenjuan Wang、Ivy A. Rosales、 Cole W. Peters、Jibing Yang、María M. Coronel、Esma S. Yolcu、Haval Shirwan 和 Andrés J. García。
这项工作得到了美国青少年糖尿病研究基金会和美国国立卫生研究院的支持。
参考资料:Deng, H., et al. (2023) Bioengineered omental transplant site promotes pancreatic islet allografts survival in non-human primates. Cell Reports Medicine. doi.org/10.1016/j.xcrm.2023.100959.






 粤公网安备 44030602007410号
粤公网安备 44030602007410号